5月27日,生命科学学院微生物学系王伟武教授课题组和中国科学技术大学生命科学学院蔡刚教授课题组合作,在《自然-通讯》(Nature Communications 2016, doi: 10.1038/ncomms11655)上发表了题为“Structure of the intact ATM/Tel1 kinase” 的文章,首次揭示了毛细血管扩张共济失调症突变蛋白-ATM激酶的同源蛋白裂殖酵母中的ATM/Tel1激酶的精细三维结构,为理解ATM/Tel1激酶的活性调控机制以及研发新型肿瘤放疗的增敏剂提供了重要线索。生科院博士研究生王雪娟为该论文第一作者,王伟武教授和蔡刚教授为论文的共同通讯作者,爱体育登录入口为该论文的第一作者单位和第一通讯作者单位。
ATM/Tel1激酶负责启动细胞对DNA双链断裂损伤的响应,可以直接磷酸化细胞内超过1000个重要底物。解析ATM/Tel1激酶的三维结构,可以帮助理解ATM/Tel1激酶活性调控的分子机制。肿瘤放疗由于其对正常组织细胞的损伤仍极大限制了其实际应用,通过选择性增强肿瘤细胞对放疗的敏感性,可以显著增强放疗的效果。近年来,ATM/Tel1抑制剂已被作为肿瘤放疗增敏剂在进行研究,因此本研究报道的8.7 Å的完整的ATM/Tel1激酶的电镜结构,不仅具有阐明基因组稳定性调控的重大科学意义,而且将对肿瘤放射治疗的新型增敏剂的研发起到重要的指导作用。

但获得原子分辨率的ATM/Tel1激酶结构,捕获ATM/Tel1激酶活化的过程,尤其是无活性同源二聚体的相互作用界面将有助于直接指导新型ATM/Tel1 抑制剂(将ATM/Tel1 锁定在无活性的二聚体)的设计,为新型ATM/Tel1抑制剂作为肿瘤放疗增敏剂提供结构基础,因此两个课题组还在继续合作研究以提高ATM/Tel1的分辨率。
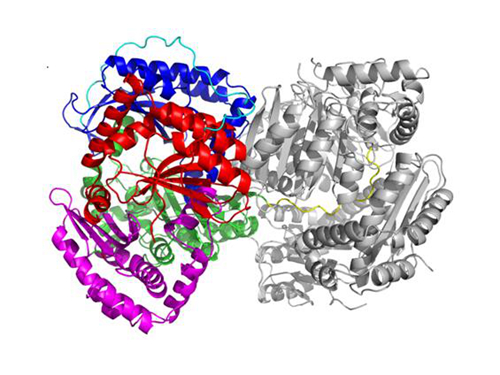
另外,王伟武教授课题组还以“Crystal Structure and Function of PqqF in the Pyrroloquinoline Quinone Biosynthetic Pathway ”为题,在《Journal of biological chemistry》上在线报道了吡咯喹啉醌(Pyrroloquinoline quinone,简称PQQ,是继黄素核苷酸(FMN,FAD)和烟酰胺核苷酸(NAD,NADP)之后被发现的第三种辅基)合成途径中的重要功能蛋白PqqF的2.5Å的晶体结构和其在PQQ合成中的作用。PqqF蛋白是PQQ合成中的唯一具有蛋白酶活性的蛋白(M16金属蛋白酶家族),可以切割前提肽PqqA,在PQQ的合成中起重要作用。在该结构中,融合蛋白表达标签中的组氨酸结合到配对分子的活性中心,形成闭合无活性的结构,这种组氨酸残基介导的抑制机制为设计抑制M16家族金属蛋白酶的抑制剂,尤其是为设计高效的胰岛素降解蛋白(IDE)的抑制剂提供了一种新的思路。该论文的第一作者为硕士生魏巧娥和冉婷婷副教授。
ATM/Tel1激酶负责启动细胞对DNA双链断裂损伤的响应,可以直接磷酸化细胞内超过1000个重要底物。解析ATM/Tel1激酶的三维结构,可以帮助理解ATM/Tel1激酶活性调控的分子机制。肿瘤放疗由于其对正常组织细胞的损伤仍极大限制了其实际应用,通过选择性增强肿瘤细胞对放疗的敏感性,可以显著增强放疗的效果。近年来,ATM/Tel1抑制剂已被作为肿瘤放疗增敏剂在进行研究,因此本研究报道的8.7 Å的完整的ATM/Tel1激酶的电镜结构,不仅具有阐明基因组稳定性调控的重大科学意义,而且将对肿瘤放射治疗的新型增敏剂的研发起到重要的指导作用。

但获得原子分辨率的ATM/Tel1激酶结构,捕获ATM/Tel1激酶活化的过程,尤其是无活性同源二聚体的相互作用界面将有助于直接指导新型ATM/Tel1 抑制剂(将ATM/Tel1 锁定在无活性的二聚体)的设计,为新型ATM/Tel1抑制剂作为肿瘤放疗增敏剂提供结构基础,因此两个课题组还在继续合作研究以提高ATM/Tel1的分辨率。

另外,王伟武教授课题组还以“Crystal Structure and Function of PqqF in the Pyrroloquinoline Quinone Biosynthetic Pathway ”为题,在《Journal of biological chemistry》上在线报道了吡咯喹啉醌(Pyrroloquinoline quinone,简称PQQ,是继黄素核苷酸(FMN,FAD)和烟酰胺核苷酸(NAD,NADP)之后被发现的第三种辅基)合成途径中的重要功能蛋白PqqF的2.5Å的晶体结构和其在PQQ合成中的作用。PqqF蛋白是PQQ合成中的唯一具有蛋白酶活性的蛋白(M16金属蛋白酶家族),可以切割前提肽PqqA,在PQQ的合成中起重要作用。在该结构中,融合蛋白表达标签中的组氨酸结合到配对分子的活性中心,形成闭合无活性的结构,这种组氨酸残基介导的抑制机制为设计抑制M16家族金属蛋白酶的抑制剂,尤其是为设计高效的胰岛素降解蛋白(IDE)的抑制剂提供了一种新的思路。该论文的第一作者为硕士生魏巧娥和冉婷婷副教授。
阅读次数:2704
【 转载本网文章请注明出处 】





